kierownik zespołu:
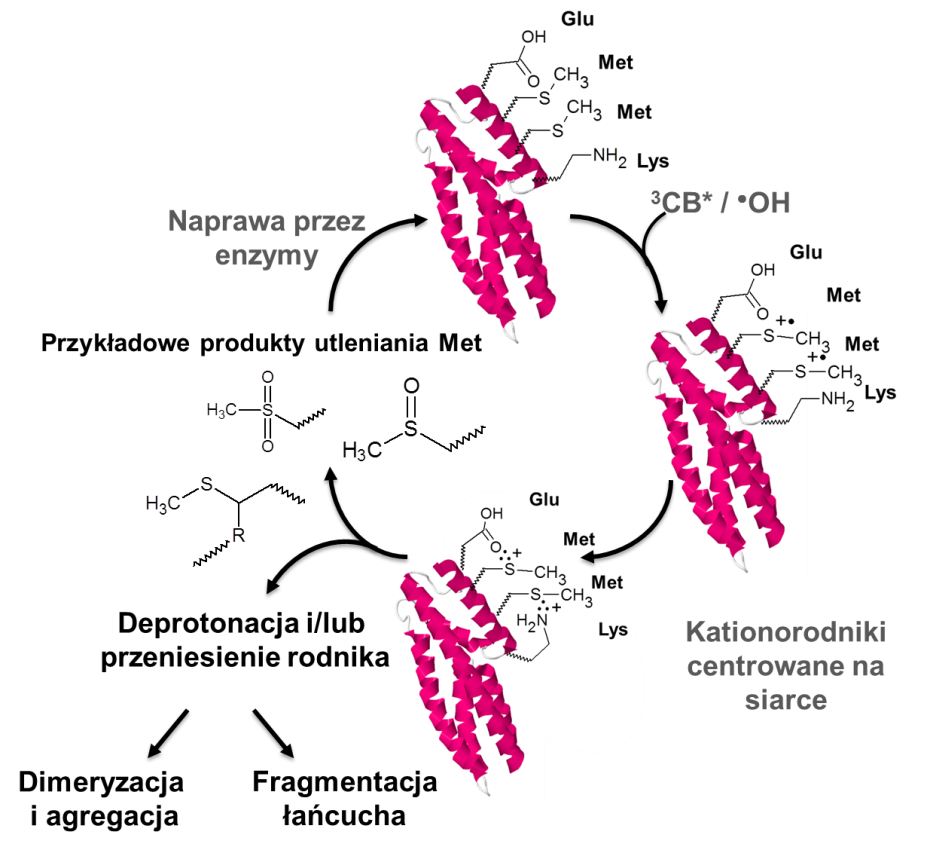
Prof. dr hab. Bronisław MarciniakCelem przedstawionego poniżej projektu jest zbadanie i zrozumienie wpływu stabilizacji kationorodników siarkowych na strukturę i stabilność białek. Białka zbudowane są z setek aminokwasów, dlatego charakterystyka procesów ich utleniania, zwłaszcza tych szybkich, jest zadaniem skomplikowanym i czasochłonnym. Wolne rodniki i utleniacze postrzegane są jako przyczyna wielu stanów chorobowych (m.in. Alzheimera) i procesów starzenia. Jednoelektronowe utleniacze (takie jak rodniki hydroksylowe i wzbudzone stany trypletowe związków aromatycznych) utleniają w niezwykle krótkich czasach białka zawierające resztę metioninową tworząc kationorodniki siarkowe Met>S●+. Indywidua te szybko ulegają deprotonacji na atomie węgla sąsiadującym z atomem siarki tworząc rodniki węglowe lub ulegają stabilizacji poprzez utworzenie nietypowych i egzotycznych wiązań dwucentrowych,trójelektronowych (2c, 3e) z wolną parą elektronową atomów S, N lub O znajdującymi się w sąsiedztwie. Związki z wiązaniami (2c, 3e) były badane przez ostatnie 20 lat, także przez grupę kierownika projektu. Jednakże w literaturze przedmiotu pojawiają się nowe prace kwestionujące istnienie tego typu wiązań lub wykazujące istnienie innych produktów pośrednich niż te, proponowane przez autorów projektu. Dlatego też bardzo ważnym aspektem z naukowego punktu widzenia i dla dalszych badań nad białkami jest jednoznaczne i dokładne scharakteryzowanie procesów stabilizacji kationorodników siarkowych. W projekcie tym zamierzamy najpierw przebadać i opisać układy modelowe, zsyntetyzowane specjalnie do tego zadania, aby ostatecznie rozwiązać kontrowersje związane z pierwszymi etapami reakcji utleniania zachodzącymi po przeniesieniu elektronu. Krótko żyjące produkty przejściowe przebadane zostaną z wykorzystaniem czasowo-rozdzielczej laserowej fotolizy błyskowej (LFP) oraz radiolizy impulsowej (PR) z detekcją optyczną (UV-Vis, Raman) i konduktometryczną. Dzięki tak szybkim metodom badawczym możemy śledzić reakcję krok po kroku w czasach nano- i mikrosekundowych. Układy modelowe zostały dobrane w taki sposób, aby możliwe było tworzenie wiązań (S∴S)+, (S∴O)+ lub (S∴N)+. Identyfikacja produktów trwałych z wykorzystaniem metod chromatograficznych i spektrometrii masowej pozwoli określić czy istnieje korelacja pomiędzy utworzonym wiązaniem (2c, 3e) a strukturą produktu trwałego. Wyniki badań uzyskane dla układów modelowych wykorzystane będą w badaniu białek zawierających od jednej do sześciu reszt metioninowych w specyficznych i różnorodnych ułożeniach w sekwencji. Jednym z przykładów białek badanych w tym projekcie jest fosfotransferaza zawierająca histydynę MtHPt1 (PDB 3US6) z Medicago truncatula (rys 1). Białko to zawiera dwie metioniny na powierzchni, które stanowią łatwy cel dla utleniaczy i rodników, znajdujące się w bliskim sąsiedztwie lizyny (układ modelowy S∴N) i kwasu glutaminowego (model dla tworzenia S∴O). Zamierzamy także przeanalizować procesy rodnikowe zachodzące w krótkich czasach (nanosekund i mikrosekund) w białkach dzięki czasowo rozdzielczej PR i LFP. Analiza produktów trwałych wykonana będzie z wykorzystaniem spektrometrii masowej, metod rentegenowskich, elektroforezy i ELYSA. Dodatkowo procesy utleniania opisane będą ilościowo z wykorzystaniem hydrolizy aminokwasowej.